品質管理体制
岩手工場のGMP管理体制
豊富な当局査察経験とシステム管理
これまでの豊富な査察経験をもとに工場のGMP管理体制を強固なものとし、医薬品原薬(API)および中間体に要求されるGMP体制を常に維持し、日々アップデートしています。日本当局や米国食品医薬品局、欧州医薬品庁など各国の法規制をクリアし、高純度医薬原料の受託製造ビジネスにおけるグローバル展開を確実なものとしています。
堅牢性の高い品質管理システム
データインテグリティ確保のため、21 CFR Part 11 に対応した監査証跡システムを有し、適切なコンピューターシステムバリデーションを実施済みの各種分析機器を保有しており、各種原薬・中間体の品質管理に活用しています。これらの電子的な記録については、設定された保存期間において、正確で完全な記録の保護・アクセス性が保証されます。
その他各種分析機器を保有しており、LIMS(ラボラトリー情報管理システム)による、適切な品質管理を徹底し、顧客・当局より高い評価を得ています。
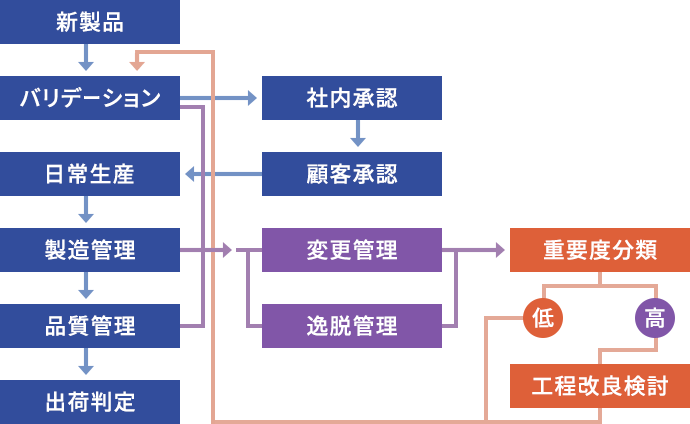
品質管理システム概要
治験薬および医薬品製造に必要なGMP体制を整備し、医薬中間体もGMPにて品質管理しています。
また、DMFの登録も実施しています。
査察実績
| 年号 | 事柄 |
|---|---|
| 1984年 | 初のFDA査察を受ける |
| 2008年 | EDQM査察を受ける |
| 2011年 | 9回目のFDA査察を受ける(10月) |
| 2016年 | 10回目のFDA査察を受ける(6月) |
| 2017年 | 11回目のFDA査察を受ける(7月) |
| 2019年 | 12回目のFDA査察を受ける(3月) |